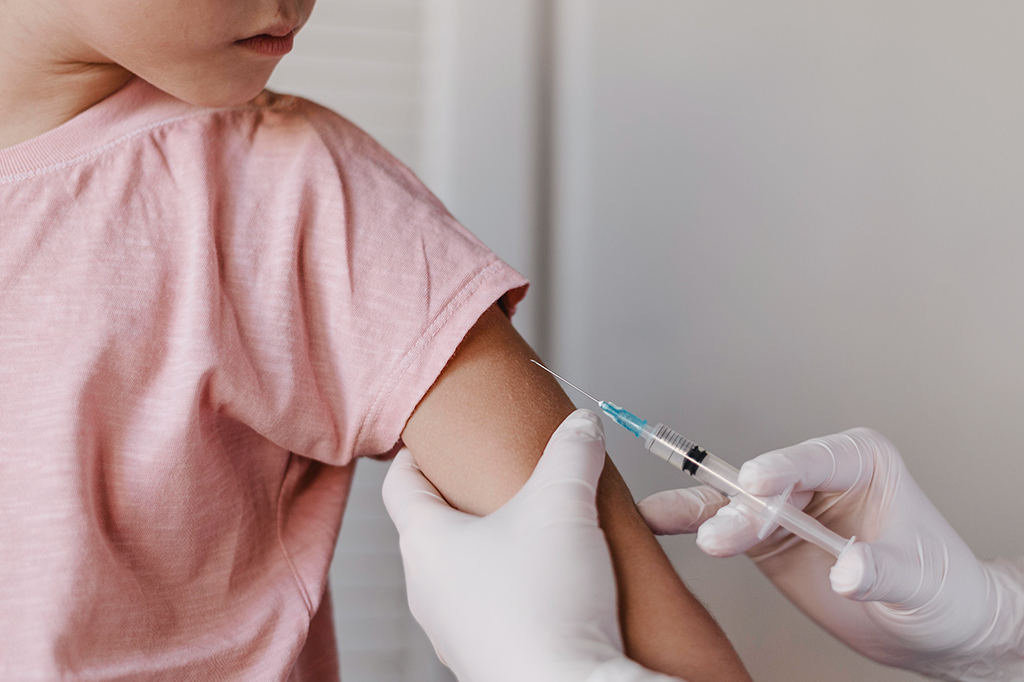
A Agência Nacional de Vigilância Sanitária (Anvisa) negou a ampliação do uso emergencial da vacina CoronaVac à população dos 3 aos 17 anos de idade. Decisão foi tomada de forma unânime em reunião extraordinária nesta quarta-feira (18).
Diretores pontuaram que não há dados suficientes sobre a eficácia da aplicação do imunizante em crianças e adolescentes. Não se sabe, por exemplo, a duração do potencial de proteção, nem como a vacina se comporta em crianças com comorbidades e imunossuprimidas.
Conforme a diretora relatora Meiruze Souza Freitas, que foi a primeira a votar contra, ainda não pode se estabelecer um perfil de segurança clínico nesse público-alvo. Ela comenta a necessidade de estudos mais robustos.
Segundo Freitas, os dados apresentados até o momento são da fase 2 do estudo. Um dos motivos também é que a aplicação em adultos, aprovada emergencialmente em sua fase 3, ainda não teve dados concluídos.
“Ainda existem dados pendentes e que não foram apresentados à Anvisa sobre a fase 3 do estudo dos adultos. Dessa forma, fica prejudicada a ampliação da CoronaVac sem os dados completos. A relação benefício-risco do uso na população pediátrica é desfavorável nesse momento”, pontua.
VOTOS
O voto da relatora Meiruze foi acompanhado integralmente pelos diretores Rômison Rodrigues, Alex Machado e Cristiane Rose Jourdan e pelo presidente da Anvisa, Antonio Barra Torres, formando uma decisão unânime.
Os diretores também acompanharam o voto da relatora no outro tópico que estava sendo analisado na reunião, que foi a autorização do uso emergencial em adultos, com base na relação benefício-risco.
A relatora Meiruze Sousa Freitas ainda pontuou que a agência deve recomendar ao Ministério da Saúde (MS) a avaliação da administração de uma 3ª dose da CoronaVac em grupos prioritários como idosos — em especial acima de 80 anos —, além de pessoas imunossuprimidas.
PEDIDO DO BUTANTAN
O pedido para ampliação do público da vacina foi feito pelo Instituto Butantan no dia 30 de julho.
Segundo a Anvisa, a solicitação para inclusão de uma nova faixa etária para a vacina deve ser feita pelo laboratório responsável pelo imunizante, que precisa conduzir estudos que demonstrem a relação de segurança e eficácia para determinada faixa etária.
Esses estudos podem ser conduzidos no Brasil ou em outros países. No caso da CoronaVac, foram fora do País.
VACINAÇÃO DE ADOLESCENTES NO BRASIL
Até agora, a única vacina autorizada pela Anvisa para uso em pessoas menores de 18 anos é a Pfizer. No dia 10 de junho, a agência liberou o uso do imunizante em adolescentes a partir de 12 anos.








